신약 개발에 성공하는건 소위 '잭팟'에 비유된다. 글로벌 신약 하나로 벤처사가 글로벌기업 반열에 오를 수 있는 곳이 제약·바이오업계다. 하지만 신약개발은 '운'으로 되는 일이 아니다. 개발 과정에 투입해야 하는 대규모 비용과 오랜 연구개발 기간이 필요하다. 더구나 신약개발 과정에는 수많은 예상하기 어려운 실패 요인들이 도사리고 있다. 그럼에도 제약·바이오산업은 대표적인 미래성장동력산업으로 꼽힌다. 우리 기업 현실은 어떨까. 주요 제약사들의 신약 파이프라인을 살펴본다. 첫 주자는 '공룡 신인' 삼성바이오에피스다. [편집자]

허셉틴은 스위스 계열 글로벌제약사 로슈(Roche)가 1998년 오리지널 바이오의약품으로 선보였다. 지난해에만 65억달러(약 7조6000억원)의 수익을 거둬들인 '글로벌 블록버스터'다. 허셉틴은 2014년 7월 유럽에서 특허가 만료됐으며, 오는 2019년 6월 미국에서 특허가 만료된다.
◇ "까다로운 유럽시장에서 승부하겠다"
허셉틴 사례에서 보듯 제약·바이오 최대시장인 미국과 유럽의 시판허가는 까다롭다. EMA에서 실패한 밀란과 바이오콘의 경우 인도에서는 올해 3월 판매를 승인받았다. 셀트리온 또한 관련 바이오시밀러인 허쥬마를 일찍이 2014년 국내에서 허가받았다. 하지만 최대 승부처는 유럽과 미국시장이다. 삼성바이오에피스의 허셉틴 바이오시밀러가 주목받는 이유다.
삼성바이오에피스는 2010년 5월 삼성그룹이 바이오제약을 '5대 신수종 사업'으로 선정하면서 2012년 2월 설립됐다.

◇ 관절염치료제 바이오시밀러 강자로 부각
삼성바이오에피스는 직원 700여명 가운데 연구개발 인력이 70% 이상이다. 설립 후 5년만에 통상 7년이상 걸리는 바이오시밀러 개발 프로세스를 4~5년으로 단축시켜 세계적으로 연구개발 플랫폼 능력을 주목받고 있다.
특히 가장 최근에 허가받은 '임랄디'에 대한 기대가 높다. 삼성바이오에피스는 지난해 6월 EMA에 임랄디 판매허가를 신청해 13개월만인 지난달 최종 승인받았다. 임랄디는 미국 다국적제약사 애브비가 2002년 선보인 오리지널 휴미라의 바이오시밀러다. 휴미라는 연간 매출이 161억달러(약 18조원)로 세계 바이오의약품중 매출 1위 제품이다.
바이오시밀러 분야에서 다국적제약사들과 자웅을 겨루는 삼성바이오에피스는 이제 오리지날 신약 개발에도 나섰다.
지난달말 일본 다국적제약사 다케다제약과 손을 잡았다. 다케다제약이 삼성바이오에피스의 개발 플랫폼을 높이 사 공동개발에 나서게 됐다. 양사는 우선 급성 췌장염 치료 후보품목인 'TAK-671' 개발에 착수하고 향후 다른 바이오신약으로 협력을 확대한다는 계획이다.
삼성바이오에피스는 지난해 9월 유럽의약품청(EMA)에 관련 신청서를 접수했다. EMA 산하 약물사용자문위원회(CHMP)가 긍정의견을 내면 통상 최종 허가까지 2~3개월이 소요되는데, 허셉틴은 이달중 CHMP의 검토를 받게 될 것으로 예측된다.
삼성바이오에피스에 한달 앞서 미국 글로벌제약사 밀란과 인도 바이오콘이 공동개발한 바이오시밀러가 미국 식품의약국(FDA)과 EMA에 판매허가를 신청했지만 탈락했다. 이들 기업은 EMA 실사(Inspection)가 연기된 뒤 지난달 자체 철회했다. FDA에선 FDA 산하 항암자문위원회의 전원일치로 승인권고를 받았지만 앞서 5~6월 진행된 실사에서 인도 벵갈루루 무균공장(sterile plant) 관련 청결 문제 등 10가지 미비점을 지적받아 판매허가가 3개월 연기됐다.
현재 FDA에서 판매허가 절차를 밟고 있는 셀트리온과 미국 다국적제약사 암젠(Amgen & Allergan) 또한 절차상 문제가 없더라도 내년 상반기중에나 허가를 취득할 것으로 전망된다.
◇ "까다로운 유럽시장에서 승부하겠다"
허셉틴 사례에서 보듯 제약·바이오 최대시장인 미국과 유럽의 시판허가는 까다롭다. EMA에서 실패한 밀란과 바이오콘의 경우 인도에서는 올해 3월 판매를 승인받았다. 셀트리온 또한 관련 바이오시밀러인 허쥬마를 일찍이 2014년 국내에서 허가받았다. 하지만 최대 승부처는 유럽과 미국시장이다. 삼성바이오에피스의 허셉틴 바이오시밀러가 주목받는 이유다.
삼성바이오에피스는 2010년 5월 삼성그룹이 바이오제약을 '5대 신수종 사업'으로 선정하면서 2012년 2월 설립됐다.
삼성그룹이 미래성장동력으로 선정해 투자에 나선만큼 국내 제약사들의 걱정이 많았다. 국내 제약시장의 판도가 달라질 것이라는 전망때문이다. 제약업계 영업분야에서는 "병원과 의원, 약국 등에서 삼성과 경쟁할 수 있겠느냐"는 우려가 많았다.
하지만 삼성바이오에피스는 국내시장보다 세계로 눈을 돌렸다. 이를 위해 국내 '3대 바이오 육성지역'중 한곳인 인천 송도국제도시에 둥지를 틀었고 해외시장 개척에 나섰다. 글로벌시장에서 한국 바이오산업이 크게 뒤처져있지만 삼성만의 기술력으로 도전해보자는 각오였다.
삼성바이오에피스 관계자는 "유럽 EMA의 경우 새로운 의약품이 개발·시판되기까지 과정을 심사·평가하는 방식이 상당히 개방적"이라며 "회사는 처음부터 유럽과 미국 시장에 관심을 두고 개발력을 키우고 있다"고 말했다.
미국에서 '바이오산업'이란 용어가 등장한 게 1993년이다. 국내에선 2002년 설립된 셀트리온이 선발주자다. 지난해 국내 바이오의약품 시장규모는 1조8300억원대로, 세계시장의 0.7%를 차지하는 데 그칠만큼 영세하다. 1위 미국과 비교하면 기술력도 평균 4.5년 뒤처진 것으로 평가된다.
이 시장에서도 후발주자인 삼성바이오에피스는 설립 2년차부터 미국 계열 다국적제약사 머크(Merck & Co), 바이오젠(Biogen Idec)과 파트너십을 체결해 세계 단위의 마케팅 네트워크를 구축했다. 의약품의 경우 개발만큼이나 어려운 것이 판매라는 점을 감안해 파트너십을 통해 '기초체력'을 다져둔 셈이다.

◇ 관절염치료제 바이오시밀러 강자로 부각
삼성바이오에피스는 직원 700여명 가운데 연구개발 인력이 70% 이상이다. 설립 후 5년만에 통상 7년이상 걸리는 바이오시밀러 개발 프로세스를 4~5년으로 단축시켜 세계적으로 연구개발 플랫폼 능력을 주목받고 있다.
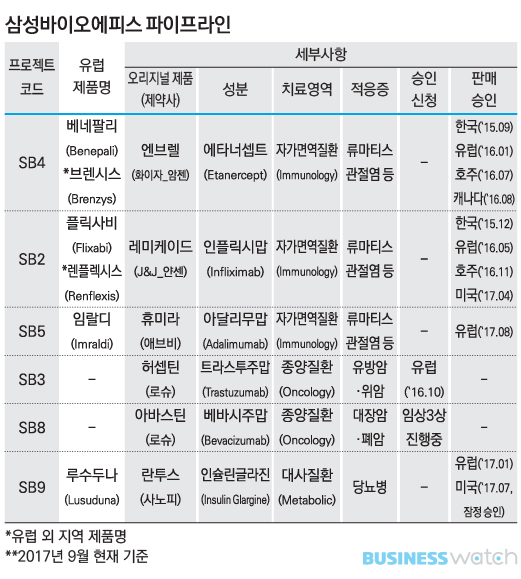
올해 9월 현재 삼성바이오에피스는 총 6개의 파이프라인(SB2~SB9)을 보유하고 있다. SB9을 제외하면 모두 자체 개발하는 바이오시밀러다. 류마티스관절염치료제 '브렌시스'와 '렌플렉시스'를 빼면 모두 해외에서 먼저 판매허가를 취득했는데, 이중 3개가 유럽의약품청(EMA)에서 받았다.
삼성바이오에피스는 특히 관절염치료제 분야에서 두드러진 성과를 보이고 있다. EMA에서 관절염치료제 3종(베네팔리·플릭사비·임랄디)에 대한 판매허가를 따내며 세계에서 가장 많이 팔리는 자가면역질환치료제(Anti TNF-a) 3종의 바이오시밀러 모두를 유럽에서 판매할 수 있는 유일한 회사가 됐다.
삼성바이오에피스의 관절염치료제 3개 제품 오리지널 의약품 매출은 지난해 총 328억달러(약 37조원)에 이른다. 국내 바이오시장은 제약시장과 합해 20조원대로 추산된다.
특히 가장 최근에 허가받은 '임랄디'에 대한 기대가 높다. 삼성바이오에피스는 지난해 6월 EMA에 임랄디 판매허가를 신청해 13개월만인 지난달 최종 승인받았다. 임랄디는 미국 다국적제약사 애브비가 2002년 선보인 오리지널 휴미라의 바이오시밀러다. 휴미라는 연간 매출이 161억달러(약 18조원)로 세계 바이오의약품중 매출 1위 제품이다.
휴미라 바이오시밀러로 유럽 판매허가를 받은건 다국적제약사 암젠에 이어 삼성바이오에피스가 두번째다. 암젠은 올해 3월 암제비타(Amjevita)와 솔림빅(Solymbic)으로 EMA 허가를 받았다.

◇ 시밀러 제품을 넘어 '오리지널신약' 도전
바이오시밀러 분야에서 다국적제약사들과 자웅을 겨루는 삼성바이오에피스는 이제 오리지날 신약 개발에도 나섰다.
지난달말 일본 다국적제약사 다케다제약과 손을 잡았다. 다케다제약이 삼성바이오에피스의 개발 플랫폼을 높이 사 공동개발에 나서게 됐다. 양사는 우선 급성 췌장염 치료 후보품목인 'TAK-671' 개발에 착수하고 향후 다른 바이오신약으로 협력을 확대한다는 계획이다.
고한승 삼성바이오에피스 사장은 "지난 5년간 바이오시밀러 연구개발을 성공적으로 수행한 플랫폼과 기술이 세계적으로 인정받은 것"이라며 "다케다제약과의 공동개발은 삼성바이오에피스의 연구개발 역량을 바이오 신약으로 확대할 수 있는 좋은 기회"라고 말했다.



















총 3개의 댓글이 있습니다.( 댓글 보기 )